1.AMAÇ
Derişimleri bilinen laktoz ve glukoz çözeltilerinden yararlanarak, abbe refraktometresi kullanılarak kırma indisi grafiği oluşturup derişimi bilinmeyen laktoz ve glukoz çözeltilerinin derişimlerinin tayin edilmesi.
2.KURAMSAL BİLGİLER
Refraktometri, her ortamın kırılma indisinin farklı olması prensibini kullanarak, konsantrasyon ve madde miktarı gibi tayinleri yapmaya yarayan bir yöntemdir. Kırılma indisi her maddeye özgü bir fiziksel özelliktir, bu sebeple kalitatif ve kantitatif analizlerde kullanabileceğimiz bir metoddur. Günümüzde organik bileşiklerin kantitatif analizinde NMR, infrared spektroskopisi gibi yöntemler daha çok tercih edilmektedir.
Bir ortamın kırılma indisine n, elektromanyetik ışımanın vakumdaki hızına c, elektromanyetik ışımanın bu ortamdaki hızına da v dersek, şöyle bir bağıntı elde ederiz:
n = c / v
Benzer maddelerin kırılma indisleri birbirine çok yakın olduğundan ( 1.25 -1.80 arası) ±0.001 duyarlılıkla ölçüm yapabilmemiz gerekir.
Işının bir ortama geliş açısına i, yansıma açısına da r dersek eğer, Snell Yasasına göre şöyle bir bağıntı yazabiliriz:
sini / sinr = v1 / v2 = n1 / n2
* v1: Işının 1. ortamdaki hızı
* v2: Işının 2. ortamdaki hızı
* n1: 1. ortamın indisi
* n2: 2. ortamın indisi
* v2: Işının 2. ortamdaki hızı
* n1: 1. ortamın indisi
* n2: 2. ortamın indisi
Işının geliş açısı, ışının hızı ve ortamın indisi ile orantılıdır. Işının geliş ve yansıma açılarını bilmemiz halinde, iki ortamın kırılma indislerinin oranlarını bulabiliriz. Ya da bir ortamın indisini biliyorsak, diğer ortamın indisini de bu bağıntı sayesinde hesaplayabiliriz.
Kırılma indisleri farklı olan bölgelerde ışının hareketi iki şekilde gerçekleşir:
n2 > n1 koşulunda, i geliş açısı, r yansıma açısından daha büyük olacaktır. Geliş açısı büyüdükçe, kırılma açısı da büyür. Buna rağmen geliş açısı, kırılma açısından her zaman daha büyüktür.
n1 > n2 koşulunda, yüksek yoğunluklu ortamdan düşük yoğunluklu ortama geçiş sırasında yansıma açısı, geliş açısından daha büyüktür. Geliş açısı büyüdükçe, yansıma açısı da 90º‘ye yaklaşır.
Kritik Açı
Işımanın 90º ’lik bir açı ile kırılmasını sağlayan geliş açısına kritik açı denir. Işının kritik açıdan daha küçük bir değerle gelmesi halinde, yansıma sonucu aydınlık bölge oluşur. Eğer ışın iki ortam arasındaki yüzeye kritik açıdan daha büyük bir açıyla gelirse, ışın kırılmaya değil, yansımaya uğrar. Yoğunluğu büyük ortama kritik açıyla gelen bir ışın, 90ºlik bir açı ile kırılır. Yoğunluğu küçük ortama 90ºlik açı ile gelen bir ışın ise yoğunluğu büyük olan ortama kritik açı ile girer. Snell yasasından yararlanarak şöyle bir bağıntı yazabiliriz:
sin Өc=n2/n1
Refraktometri cihazının içerisinde prizmalar kullanılır. Gönderdiğimiz ışın örnekten geçip prizmaya değişik açılarla gelir. Eğer geldiği açılar kritik açıdan küçükse, aydınlık bölge oluşur. Kritik açıdan büyük açılarla gelmişse, karanlık bölge oluşur. Karanlık ve aydınlık bölgenin sınırı kritik açıya karşılık gelir. Bir maddenin kırılma indisi, kullanılan ışımanın dalga boyuna, sıcaklığa ve derişime bağlıdır. Bunun dışında sıkıştırılabilen maddelerin kırılma indisi, basınca bağlı olarak da değişir. Dalga boyunun kırılma indisine etki etmesinden dolayı, kullandığımız ışımanın dalga boyunu da belirtmeliyiz. Ticari refraktometrelerde genellikle sodyumun atomunun yaydığı yaklaşık eşit şiddetlerdeki, 589.0 ve 589.6 nm ‘deki hatları kullanılır. Bu hatlar sodyum D hatları olarak adlandırılır.
Abbe Refraktometresi
Kırılma indisi tayininde kullandığımız alete Abbe Refraktometresi denir. Abbe refraktometresinde iki prizmanın arasına kırılma indisini tayin edeceğimiz maddeyi sıvı film olarak yerleştiririz. Prizmalara gönderdiğimiz ışık ile, kritik açıdan daha küçük açı ile gelen ışınların oluşturduğu aydınlık bölge ve kritik açıdan daha büyük açıyla gelen ışınların oluşturduğu aydınlık bölgeyi görebiliriz.
Nicel Analiz: Ölçtüğümüz kırılma indisi değerlerini, saf maddelerinin kırılma indisi değerleri ile karşılaştırarak refraktometrik nicel analizi gerçekleştirmiş oluruz. Eğer karşılaştırma yapacağımız standart bir indis değeri bulamazsak, Lorentz-Lorenz molar kırılma indisini buluruz. Bu değer R ile gösterilir ve
R=(n²-1)xM/(n²+2) x d ile de formülize edilebilir.
M, molekülün molar ağırlığı, d ise yoğunluğudur. Buradan R değerini buluruz ve bilinen değerler ile hesapladığımız R´ değeriyle karşılaştırma yaparız.
Kırılma İndisi
Işığın boşluktaki yayılma hızının made içindeki yayılma hızına oranına kırılma indisi, denir.
Refraktometreler “Kritik Işın” ve kritik açının sağladığı olanaklardan yararlanılarak yapılmıştır. Normalle ( yaklaşık 90°) açı yaparak yani yüzeye paralel olarak gelen ışın ile artık kırılma açısından daha büyük açıda kırınan ışın elde edilemiyorsa bu ışına kritik ışın, açıya da kritik açı adı verilir. Işının çıktığı yüzeyden örneğe bakıldığında yüzeyin bir kısmı karanlık, bir kısmı aydınlık görülür. Bu bölgelerin büyüklüğü kırılma açısının büyüklüğü ile ilgilidir.
Kırılma indisini sıcaklık, ışığın dalga boyu ve basınç etkiler. Ortamın soğurma yapmadığı dalga boyunda dalga boyu değeri atttıkça kırılma indisi azalır.
Ortamın soğurma yaptığı dalga boyu yakınlarında ise dalga boyu değeri arttıkça kırılma indisi artar.Kırılma indisi ölçümü genelde çoğu kez sodyumun D yayım çizgisinde yapılır.Kırılma indisinin ölçüldüğü ışın alt indis ve ortamın sıcaklığı üst indis olacak şekildeyazılır. nD20 gibi.
Kırılma İndisi Ölçümünün Kullanıldığı Yerler
Kırılma indisi E.N ve K.N. gibi bir kimyasal türün belirlenmesinde kullanılan sabitlerdendir.
Endüstride saflık kontrolünde kullanılır. Kırılma indisleri ile derişim arasındaki ilişkiden derişim tayini yapılabilir. Şeker tayininde, camda SiO2 tayininde ve petrolde aromatik hidrokarbonların analizinde de kırılma indisinden faydalanılmaktadır.
Endüstride saflık kontrolünde kullanılır. Kırılma indisleri ile derişim arasındaki ilişkiden derişim tayini yapılabilir. Şeker tayininde, camda SiO2 tayininde ve petrolde aromatik hidrokarbonların analizinde de kırılma indisinden faydalanılmaktadır.
3.KULLANILAN MALZEMELER
- Abbe Refraktometresi
- Damlalık
- Beher
- Çeşitli konsantrasyonlarda hazırlanmış glukoz çözeltisi (%1, %2, %3, %4, %5)
- Çeşitli konsantrasyonlarda hazırlanmış laktoz çözeltisi (%1, %2, %3, %4, %5 )
4.DENEYİN YAPILIŞI
Deneye başlamadan önce cihazımızın kalibrasyonunu gerçekleştirdik. Kalibrasyon işlemini saf su ile yaptık çünkü kullanmış olduğumuz çözücü sudur. Daha sonra %1, %2, %3, %4, %5 lik glukoz çözeltilerinden abbe refraktometresine sırayla %1 lik glukoz çözeltisinden birkaç damla prizma üzerine damlatıldı ve diğer prizma kapatıldı. Yayılan glukoz çözeltisi mercekten bakıldı karanlık ve aydınlık bölgeler görüldü. Karanlık ve aydınlık bölgeyi ayıran saç teli çarpı işaretinin tam ortasına getirilince okuma tuşuna basılarak kırma indisi okundu. Daha sonra %2 lik çözeltinin kırma indisini ölçmeden önce prizmalar etanol ile iyice silindi ve %2lik çözeltiden 2 damla prizma üzerine damlatılarak ölçüm yapıldı. Bu işlem diğer çözeltiler içinde tekrarlanarak kırma indisleri kaydedildi. Aynı işlem laktoz çözeltisi içinde yapıldı.
5.Veriler ve hesaplamalar
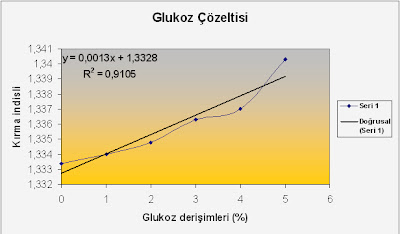
Tablo.1:Glukoz çözeltilerinin kırma indisleri değerleri
Glikoz çözeltilerinin derişimleri | Kırma indisleri |
%0 | 1,3334 |
%1 | 1,3340 |
%2 | 1,3348 |
%3 | 1,3363 |
%4 | 1,3370 |
%5 | 1,3403 |
Bilinmeyen çözelti | 1,3370 |
Grafik.1:Glukoz derişimlerine karşı kırma indisleri grafiği
Grafikten yararlanılarak denklem bulunur ve bu denklemde konsantrasyonu bilinmeyen glukoz çözeltisinin konsantrasyonu tayin edilmiş olunur. Bilinmeyen glukoz çözeltimizin kırma indisi 1,3370 olarak cihazımızda okunmuştu.
y=0,0013x + 1,3328
1,3370 = 0,0013x +1,3328
X = %3,231 bilinmeyen glukoz çözeltisinin yüzde derişimi
Tablo.2:Laktoz çözeltileri derişimleri ve kırma indisi değerleri
Laktoz çözeltileri derişimleri | Kırma indisi |
0 | 1,3334 |
%1 | 1,3354 |
%2 | 1,3364 |
%3 | 1,3377 |
%4 | 1,3391 |
%5 | 1,3404 |
Bilinmeyen çözelti için | - |
Grafik.2:Laktoz çözeltisi derişimlerine karşı kırma indisleri değerleri
Grafikten yararlanılarak denklem bulunur ve bu denklemde konsantrasyonu bilinmeyen laktoz çözeltisinin konsantrasyonu tayin edilebilir.